الکتروشیمی:
- علمی است که جهان شیمی با جهان الکتریسیته همراه می شود.
- هنگامی که انرژی شیمیایی تبدیل به انرژی الکتریکی می شود و سپس به انواع دیگر انرژی مانند نور یا گرما تبدیل می شود.
الکتریسیته: جریان الکترونها از طریق یک مسیر (معمولا سیم) است.
سل الکتروشیمیایی: ابزاری است که انرژی الکتریکی را به شیمیایی تغییر می دهد.
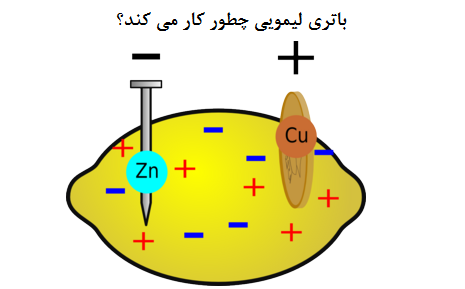
سل الکتروشیمیایی محتوی دو محفظه است که هر محفظه دارای یک الکترود است که این الکترود در الکترولیت قرار دارد. الکترود رسانا است و معمولا فلز می باشد. الکترولیت هم یک ماده ای است که الکتریسیته را هدایت می کند. یکی از صفحات الکترود، مثبت و دیگری منفی است. این دو صفحه کاند و آند نامیده می شوند و آنها به وسیله یک سیم به هم متصل می شوند و مدار کامل می شود.
اغلب یکی از صفحات فلزی در باتری ها، مس است که به عنوان کاتد عمل می کند. کاتد، الکترودی است که در آن کاهش رخ می دهد و الکترون ها به دست می آیند. صفحه دیگر در باتری ها آند است و اغلب روی می باشد. آند، جایی است که اکسیداسیون اتفاق می افتد و الکترون ها از دست می روند. الکترونها از آند جدا می شوند و به سیم می روند.
محلول های دو الکترود به رسانش الکترون ها از سطح الکترود به سیم کمک می کند. دو الکترود در محفظه های جداگانه ای هستند که توسط یک پل نمکی جدا می شوند. با استفاده از پل نمکی، یون ها در هر دو محلول از یک طرف به طرف دیگر حرکت می کنند تا بار الکتریکی در هر نیم سل خنثی گردد.
واکنش شیمیایی که در سلول الکتروشیمیایی رخ می دهد، واکنش ردوکس یا اکسایش-کاهش است. همانطور که از نام آن بدست می آید، واکنش ساخته شده از دو بخش است: یک واکنش کاهش که در آن الکترون ها به دست می آیند و یک واکنش اکسیداسیون که الکترون ها از دست می دهند.